Propriétés électriques des diamants
Sommaire : Propriétés électriques des diamants
À l’exception de cas très rares de présence de bore dans sa structure, le diamant est un très bon isolant électrique, à cause de l’immobilisation des électrons suite à leur liaison covalente. Cette propriété est mise à profit lors de la taille automatique. Il y a cependant une exception ; en effet, le diamant noir est conducteur d’électricité (voir plus loin).
Impuretés dans les semi-conducteurs
Les semi-conducteurs aux larges zones intermédiaires interdites, ne transmettent pas l’électricité à température ambiante. Ceci est dû à l’excitation régnante qui peut franchir ces zones interdites. La présence de certaines impuretés peut donc influencer la conductibilité, ainsi que l’absorption lumineuse.
La structure du diamant inclut des atomes N. Comme N possède un électron de plus que C, chaque atome N produira un électron (donneur) de plus pourvu d’une énergie située au-dessus du niveau de Fermi dans la zone interdite. Ce niveau porte le nom de niveau d’impureté ou niveau du donneur.
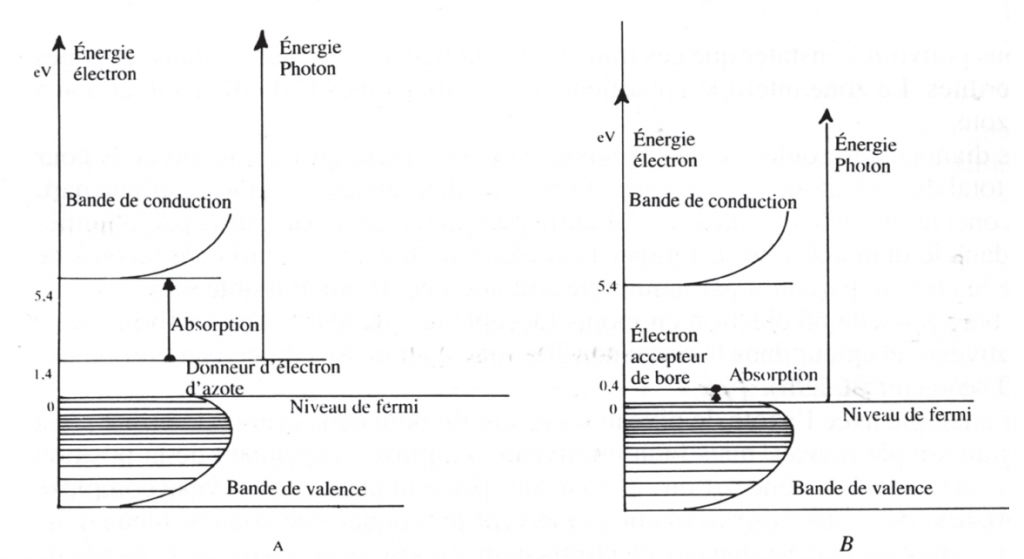

Le niveau d’impureté de l’azote se situe à 4 eV en dessous de la bande de conduction, ce qui permet d’absorber la lumière de 4 eV ainsi que celle de plus haute énergie. Ceci excite suffisamment l’électron pour atteindre la bande de conduction, schéma représenté sous l’illustration. Dans la zone visible, par contre, seule la lumière bleue à violette ayant une énergie de 2,5 à 3,3 eV peut être absorbée. L’électron est par conséquent excité et la couleur complémentaire au bleu violet, c’est-à-dire le jaune, est perçue.
Nous pouvons constater que ces transitions ont lieu d’elles-mêmes dans les zones interdites. La zone interdite appartient en fait aux atomes C du diamant, et non à l’azote.
La saturation de couleur augmente grâce à, d’une part, la concentration des atomes N, et d’autre part, la distance parcourue par la lumière dans le diamant. Pour estomper la couleur, le diamant est taillé de façon à ce que le chemin parcouru par la lumière soit aussi court que possible ; par contre pour les diamants de couleur fantaisie nous choisirons plutôt une 106 taille fantaisie dans laquelle le chemin parcouru par la lumière sera le plus long possible. Le bore possède un électron en moins (accepteur) que le carbone et forme donc un niveau récepteur dans la zone interdite, située au-dessus du niveau Fermi pour B 0,4 eV.
Par analogie avec l’azote, le niveau récepteur du bore dans la zone interdite n’est pas un simple niveau, mais bien un niveau complexe. Dépendant de la position dans la bande de valence, d’où ces électrons peuvent passer à ce niveau complexe de 0,4 eV, de nombreuses transitions peuvent provoquer une couleur bleue.
Une autre conséquence est que ces électrons peuvent aisément passer de la bande de valence à ce niveau récepteur, ce qui provoque, dans la bande de valence, des poches (cavités) vides qui peuvent bouger sous l’influence d’un champ électrique, ce qui fait du diamant bleu un conducteur d’électricité. Ce phénomène concerne les diamants naturels comme les diamants synthétiques bleus, qui comportent du bore dans leur structure.
Le diamant irradié de couleur bleue est produit par des centres de couleur induits (vacatures), ce qui fait qu’il n’est pas conducteur d’électricité.
La concentration de bore des diamants bleus comporte environ un atome de bore pour une concentration de l’ordre de 1000000e d’atomes C.
L’élément Al, fréquemment présent dans le diamant, possède également un atome de moins que C, et ne provoque pas de couleur bleue. Une théorie dépassée soutient que ceci est dû au fait que le niveau d’impureté ne peut pas être atteint par une excitation thermique normale de l’électron qui se trouve dans la bande de valence de C.
Par la synthèse de diamants qui présentent les empreintes B ou Al, on a pu prouver que le B, et non le Al était responsable de la coloration bleue. On peut déterminer si le diamant doit sa couleur bleue à l’irradiation ou à la présence d’atomes B dans le réseau, en démontrant la conductibilité électrique des pierres qui comportent des atomes B. Les diamants bleus irradiés ne présentent pas de conductibilité électrique. L’exception à cette règle est formée par le fameux « diamant noir » Il présente une conductibilité parfois aussi puissante que celle du métal (par exemple le cuivre), mais uniquement aux endroits où l’on touche une grande concentration en graphite. L’ohmmètre permet de mesurer cette concentration, elle est détectable sur les diamants bruts et taillés.
N.B. : Une étude concernant la conductibilité électrique m’a permis de constater que le diamant noir naturel est souvent conducteur à 100 %. Ceci est dû à la présence massive d’inclusions de graphite.
Dans le secteur des écrans d’ordinateurs et de télévision, le diamant pourrait aussi jouer un rôle important dans le futur, grâce à ses propriétés de semi-conducteur. Le diamant synthétique décharge des électrons lorsqu’il est sujet à de faibles champs électriques. Le diamant pourrait ainsi détrôner les cristaux liquides et les tubes cathodiques, ce qui permettra de fabriquer des écrans de plus en plus plats, tellement convoités.
© Dureté 10 – Eddy Vleeschdrager





